что легче вступает в реакцию с металлом
Что легче вступает в реакцию с металлом?
Вопрос о том, что легче вступает в реакцию с металлом⁚ кислоты, щелочи или соли, не имеет однозначного ответа. Все зависит от конкретного металла, его химических свойств и условий реакции. Например, некоторые металлы, такие как железо, легко реагируют с кислотами, образуя соли и водород. Другие металлы, например, золото, практически не реагируют ни с кислотами, ни с щелочами.
Кислоты
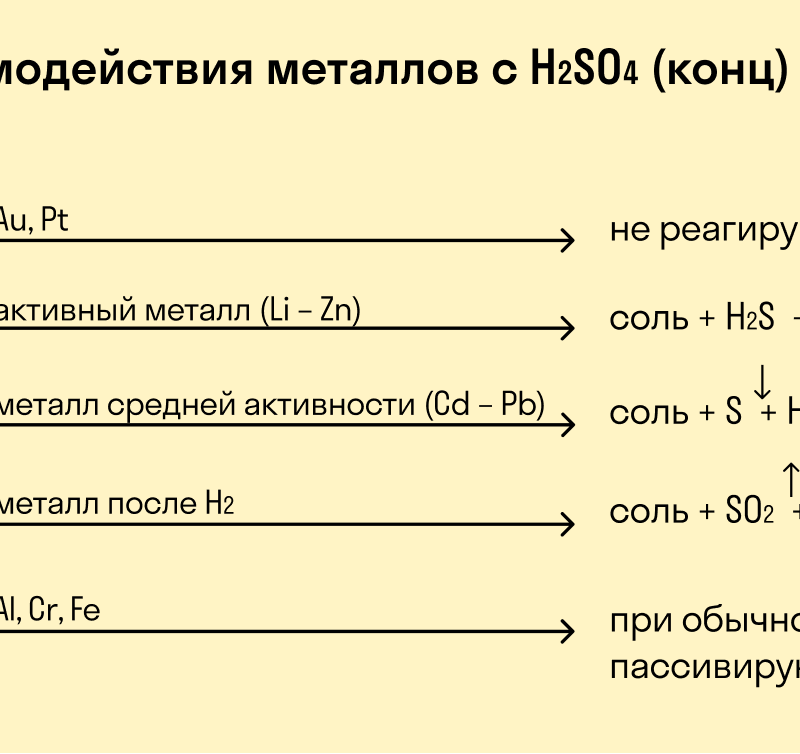
Кислоты, как правило, более активно реагируют с металлами, чем щелочи или соли. Это связано с тем, что кислоты содержат ионы водорода (H+), которые способны отрываться от молекулы кислоты и взаимодействовать с атомами металла. В результате этой реакции образуются соли и выделяется водород.
Например, железо (Fe) легко реагирует с соляной кислотой (HCl), образуя хлорид железа (FeCl2) и водород (H2)⁚
Fe + 2HCl → FeCl2 + H2
Однако, не все металлы одинаково легко реагируют с кислотами. Благородные металлы, такие как золото (Au) и платина (Pt), практически не реагируют с кислотами.
Важно отметить, что скорость реакции между кислотой и металлом зависит от ряда факторов, таких как концентрация кислоты, температура, наличие катализатора и поверхность металла.
Например, разбавленная соляная кислота будет реагировать с железом медленнее, чем концентрированная. Повышение температуры также ускорит реакцию.
Таким образом, хотя кислоты, как правило, более активно реагируют с металлами, чем щелочи или соли, скорость и характер реакции могут значительно варьироваться в зависимости от конкретных условий и свойств металла.
Щелочи
Щелочи, также известные как основания, представляют собой химические соединения, которые в водном растворе диссоциируют на ионы гидроксида (OH-) и катион металла. В отличие от кислот, щелочи, как правило, менее активно реагируют с металлами.
Однако, некоторые металлы, такие как алюминий (Al) и цинк (Zn), могут реагировать со щелочами, образуя соли и водород.
Например, алюминий реагирует с гидроксидом натрия (NaOH), образуя алюминат натрия (NaAlO2) и водород (H2)⁚
2Al + 2NaOH + 6H2O → 2NaAlO2 + 3H2
Реакция между щелочью и металлом может быть более сложной, чем реакция с кислотой. Она может зависеть от концентрации щелочи, температуры, наличия катализатора и других факторов.
Например, некоторые металлы, такие как железо, не реагируют со щелочами при комнатной температуре, но могут реагировать при повышенной температуре.
В целом, можно сказать, что щелочи менее активно реагируют с металлами, чем кислоты. Однако, некоторые металлы могут реагировать со щелочами, образуя соли и водород, в зависимости от конкретных условий реакции.
Соли
Соли представляют собой химические соединения, которые образуются при взаимодействии кислоты и основания. Они состоят из катиона металла и аниона кислотного остатка. В отличие от кислот и щелочей, соли, как правило, не вступают в реакцию с металлами.
Однако, некоторые соли могут реагировать с металлами в определенных условиях. Например, соли тяжелых металлов, такие как соли меди (Cu), серебра (Ag) и ртути (Hg), могут реагировать с некоторыми металлами, вытесняя их из раствора.
Например, медь (Cu) может реагировать с раствором сульфата железа (FeSO4), вытесняя железо (Fe) из раствора и образуя сульфат меди (CuSO4)⁚
Cu + FeSO4 → CuSO4 + Fe
Эта реакция называется реакцией замещения. Она происходит, потому что медь (Cu) более электроотрицательна, чем железо (Fe), и поэтому она может вытеснить железо (Fe) из раствора.
Однако, большинство солей не реагируют с металлами. Это связано с тем, что соли уже представляют собой стабильные соединения, и они не склонны к дальнейшим реакциям с металлами.
В целом, можно сказать, что соли менее активно реагируют с металлами, чем кислоты и щелочи. Однако, некоторые соли могут реагировать с металлами в определенных условиях, например, в реакции замещения.
Факторы, влияющие на скорость реакции
Скорость реакции между металлом и раствором зависит от нескольких факторов⁚
- Природа металла⁚ Активные металлы, такие как щелочные металлы (натрий, калий) и щелочноземельные металлы (кальций, магний), реагируют с растворами быстрее, чем менее активные металлы, такие как золото или платина. Активность металла определяется его положением в ряду активности металлов.
- Концентрация раствора⁚ Чем выше концентрация раствора, тем быстрее происходит реакция. Это связано с тем, что большее количество реагирующих частиц находится в контакте друг с другом.
- Температура⁚ Повышение температуры ускоряет скорость реакции. Это связано с тем, что при повышении температуры частицы движутся быстрее, увеличивается вероятность столкновений и, следовательно, происходит больше реакций.
- Поверхность контакта⁚ Чем больше площадь поверхности контакта между металлом и раствором, тем быстрее происходит реакция. Это связано с тем, что большее количество реагирующих частиц находится в контакте друг с другом. Например, порошок металла будет реагировать быстрее, чем кусок металла того же размера.
- Наличие катализатора⁚ Катализатор ⏤ это вещество, которое ускоряет скорость реакции, не расходуясь в процессе. Например, некоторые металлы, такие как никель (Ni), могут использоваться в качестве катализаторов в реакциях с участием водорода (H2).
Важно отметить, что эти факторы могут взаимодействовать друг с другом. Например, повышение температуры может ускорить реакцию, но только если концентрация раствора достаточно высока.
Понимание факторов, влияющих на скорость реакции, позволяет нам контролировать скорость реакции и оптимизировать ее для конкретных целей.